Ihr Medizinprodukt darf bei sachgemäßer Anwendung keine vermeidbaren Risiken für Patienten, Anwender oder Dritte darstellen.
Hierfür sind Sie als Hersteller oder Ihr Bevollmächtigter verantwortlich und bestätigen dies in der EU-Konformitätserklärung zur Medizinprodukte-Verordnung (EU) 2017/754. Basis dafür ist die Technische Dokumentation, die Grundlegende Sicherheits- und Leistungsanforderungen (GSPR) und die Risikobewertung für Ihr Produkt umfasst. Die Technische Dokumentation zu Ihrem Produkt erfordert daher ein überlegtes Vorgehen – von der Planung bis zum Bericht.
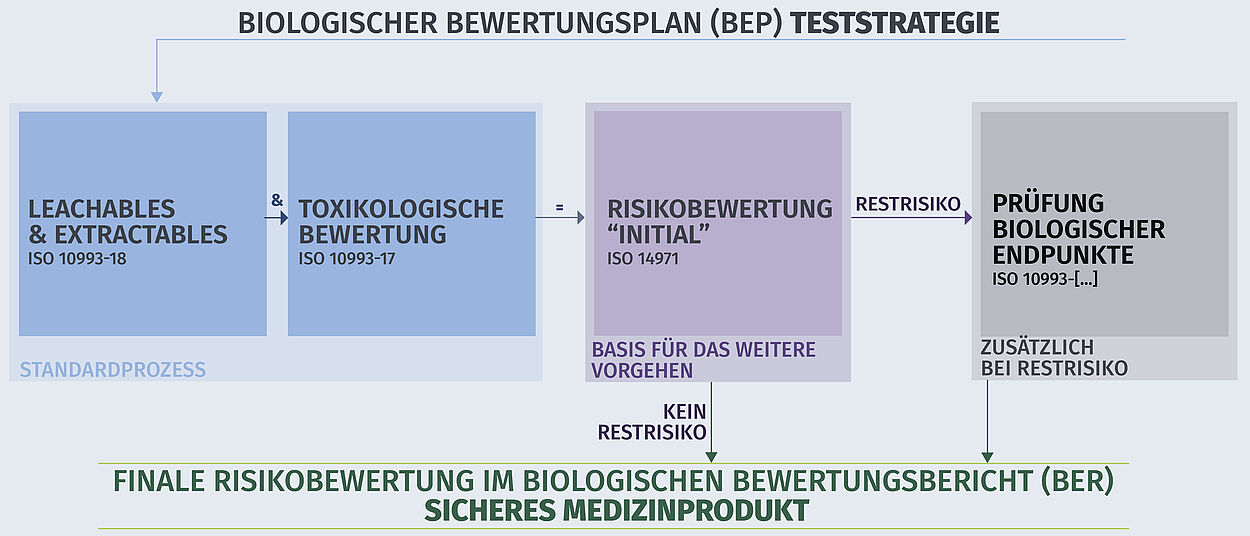
Grundlage für die Biologische Beurteilung von Medizinprodukten ist die Normenreihe DIN EN ISO 10993. Die DIN EN ISO 10993-1 legt fest, welche Endpunkte Sie bei der biologischen Risikobewertung Ihres Produkts berücksichtigen müssen. – Nutzen Sie dazu auch unseren Produkt Finder!
Wie helfen Ihnen unsere Prüfungen?
Unsere Prüfergebnisse unterstützen die Dokumentation und Bewertung wichtiger Aspekte der Biokompatibilität Ihres Medizinprodukts – von der Materialauswahl, über die Toxikologischen Risikobewertung (TRA) und den Materialeigenschaften auch nach Alterung oder Aufbereitung (Reinigungs- und Sterilisationsprozesse gemäß ISO 17664) bis hin zur Überwachung des Produkts nach dem Inverkehrbringen (Post-Market Surveillance).